tema: configuración electrónica y números cuánticos
grado: 1o°
estándares :
Uso la tabla periódica para determinar propiedades físicas y químicas de los elementos.
Explico la relación entre la estructura de los átomos y los enlaces que realiza.
Establece relación entre la configuración electrónica de un elemento y su posición en la tabla.
Determina el periodo, grupo y el número de electrones por nivel para un átomo dado, a partir de la configuración electrónica.
Identifica los electrones de los átomos de un elemento determinado por medio de su respectivo número cuánticos.
Describe la forma de los orbitales s, p, d y f, el número de ellos en cada subnivel y su población electrónica máxima.
Realiza la configuración electrónica de los elementos y la relaciona con la ubicación de los elementos en la tabla periódica.
actividad de inicio
Recuerda que lo átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas. Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.
Vamos a estudiar la configuración electrónica o también llamada distribución electrónica. Abajo del todo tienes una tabla con la configuración electrónica de todos los elementos, pero aquí vamos a explicarte como se hace.
Primero te vamos a explicar todo de forma sencilla para que lo entiendas. Luego te enseñaremos una regla muy sencilla para obtener la configuración electrónica de cualquier elemento, pero es bueno que intentes entender el cómo y el por qué. Por eso empezaremos por el principio para que nos resulte fácil.
configuración electrónica
La Configuración o Distribución electrónica nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
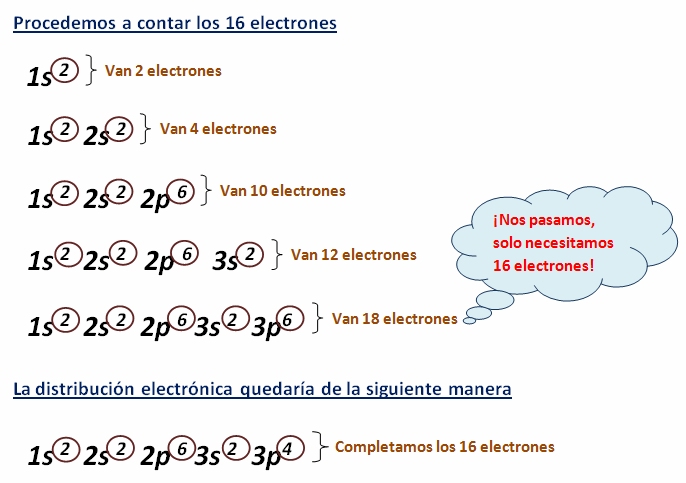
La configuración electrónica consiste en la distribución de
los electrones en los diferentes orbitales de un átomo, y para desarrollarla se
aplica la Regla de las Diagonales: Se toman las flechas de arriba
hacia abajo y del extremo superior a la punta, una tras otra. Así que en cada
orbital, se deberán llenar con 2 electrones máximo (Primero el orbital 1s= 2e-;
después 2s= con 2e-; después el 2p= 6e- y así sucesivamente hasta llegar a
los subniveles u orbitales d con 10e- y los subniveles f con 14
e- ; realizaremos este llenado hasta que completemos el número de
electrones que contiene el átomo).
Nivel 3: s p d
Nivel 4: s p d f
Por ejemplo, el 4s se completa antes del 3d y el 5s antes del 4d (salvo excepciones).
¿Cómo se determina la configuración electrónica de un átomo?
- colocando el número adecuado de nucleidos (protones + neutrones) en el núcleo, según como esté especificado en el número atómico del elemento y su número de masa.
- colocando el número necesario de electrones en los orbitales en modo de obtener la menor energía total posible.
Nivel 3: s p d
Nivel 4: s p d f
Por ejemplo, el 4s se completa antes del 3d y el 5s antes del 4d (salvo excepciones).
1 – Para determinar la configuración electrónica de un elemento se sigue el principio de aufbau (aufbau, es una palabra alemana que significa “construir”). Tal principio dice que la configuración electrónica de un átomo se “construye” del siguiente modo:
2 – La configuración electrónica debe respetar el principio de exclusión de Pauli. Este principio dice que no existen 2 electrones con los cuatro números cuánticos iguales , por lo tanto, cada orbital puede contener solo 2 electrones, con espín opuesto.
3 – También hay que tener en cuenta el principio de la máxima multiplicidad o también llamado “Principio de Hund” que dice como se deben completar los orbitales. Los electrones tienden a ocupar todos los orbitales disponibles y solo una vez que todos los orbitales se encuentran parcialmente ocupados (es decir, se posiciona 1 electrón por cada orbital), luego se disponen en pares.
Parece complicado pero resultará más fácil una vez visto el lado practico, que veremos a continuación.
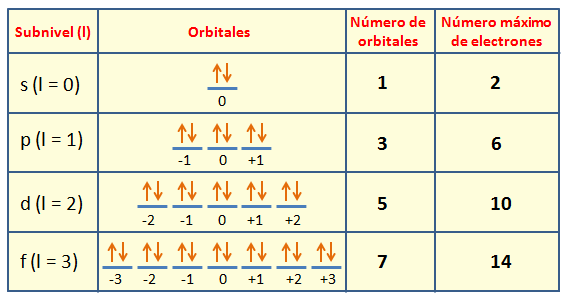
Orbitales en cada nivel energético.
Nivel 1: contiene solo orbitales de tipo s
Los orbitales s contienen al máximo 2 electrones; los p, 6 electrones; los d, 10 electrones; los f, 14 electrones.
Primero hay que completar los orbitales s del nivel sucesivo antes de completar los d. Esto se debe a que experimentalmente se ha observado que tal configuración hace que el átomo tenga una energía global lo mas baja posible.
Número cuántico principal n
Determina el nivel energético de la región que ocupa el electrón. Cuanto mayor sea n, mayor es la energía de la nube electrónica. Cabe hacer notar que el movimiento de los electrones en estos niveles no es uniforme y la forma circular es sólo ilustrativa de éstas divisiones. Sus valores van desde el 1 en adelante, según el nivel donde se encuentre el electrón.
Número cuántico secundario o azimutal l
Determina la forma de la nube electrónica. Físicamente corresponde a la zona más probable donde encontrar un electrón. El número cuántico azimutal es propio de cada orbital y es independiente del nivel energético en el que probablemente se encuentre el electrón. Por convención los valores permitidos para los orbitales s, p, d y f son:
Orbital s: 0
Orbitales p: 1
Orbitales d: 2
Orbitales f: 3
Número cuántico magnético m
Determina la orientación espacial de la nube electrónica en respuesta al campo magnético ejercido por el núcleo atómico. Éste número magnético depende del azimutal y toma valores desde - hasta + pasando por cero.
ejem:
-3 -2 -1 0 +1 +2 +3
Numero cuántico de spin
Si consideramos el electrón como una pequeña esfera, lo que no es estrictamente cierto, puede girar en torno a sí misma, como la Tierra gira ocasionando la noche y el día. Son posibles dos sentidos de giro, hacia la izquierda o hacia la derecha. Este giro del electrón sobre sí mismo está indicado por el número cuántico de espín, que se indica con la letra s. Como puede tener dos sentidos de giro, el número de espín puede tener dos valores: ½ y - ½.
Número cuántico principal n
Determina el nivel energético de la región que ocupa el electrón. Cuanto mayor sea n, mayor es la energía de la nube electrónica. Cabe hacer notar que el movimiento de los electrones en estos niveles no es uniforme y la forma circular es sólo ilustrativa de éstas divisiones. Sus valores van desde el 1 en adelante, según el nivel donde se encuentre el electrón.
Número cuántico secundario o azimutal l
Determina la forma de la nube electrónica. Físicamente corresponde a la zona más probable donde encontrar un electrón. El número cuántico azimutal es propio de cada orbital y es independiente del nivel energético en el que probablemente se encuentre el electrón. Por convención los valores permitidos para los orbitales s, p, d y f son:
Orbital s: 0
Orbitales p: 1
Orbitales d: 2
Orbitales f: 3
Número cuántico magnético m
Determina la orientación espacial de la nube electrónica en respuesta al campo magnético ejercido por el núcleo atómico. Éste número magnético depende del azimutal y toma valores desde - hasta + pasando por cero.
ejem:
-3 -2 -1 0 +1 +2 +3
Numero cuántico de spin
Si consideramos el electrón como una pequeña esfera, lo que no es estrictamente cierto, puede girar en torno a sí misma, como la Tierra gira ocasionando la noche y el día. Son posibles dos sentidos de giro, hacia la izquierda o hacia la derecha. Este giro del electrón sobre sí mismo está indicado por el número cuántico de espín, que se indica con la letra s. Como puede tener dos sentidos de giro, el número de espín puede tener dos valores: ½ y - ½.